Desacanggu.id – Apa yang dimaksud dengan derajat ionisasi? Bagi yang masih awam tentu tidak begitu paham dengan istilah tersebut. Jika saat ini kamu tengah mempelajari materi tersebut, maka ulasan tentang derajat ionisai, pengertian, rumus dan contohnya berikut ini bisa sangat membantu.
Sebelum masuk pada pembahasan derajat ionisasi, ada baiknya kamu ketahui dulu apa yang dimaksud dengan ionisasi. Secara umum, ionisasi bisa diartikan sebagai proses terurainya zat elektrolit hingga membentuk partikel yang memiliki muatan listrik atau ion.
Sebagai informasi, ion positif dikenal dengan istilah kation sementara ion negatif dikenal dengan istilah anion. Pada zat elektrolit sendiri larutannya ada yang lemah dan kuat. Untuk tahu lebih jauh tentang derajat ionisasi, pengertian, rumus dan contohnya, kamu bisa simak pembahasan di bawah ini.
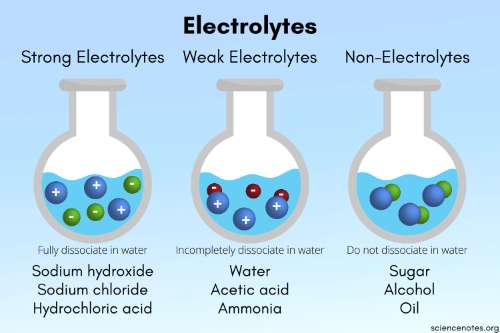
Elektrolit Kuat, Elektrolit Lemah dan Non Elektrolit
Sebelum membahas tentang derajat ionisasi, kita akan mengulas kembali tentang zat elektrolit kuat dan lemah. Seperti yang diketahui, larutan elektrolit kuat adalah larutan yang mampu terurai sempurna sementara pada larutan elektrolit lemah hanya sebagian saja yang terurai.
1. Elektrolit Kuat
Contoh elektrolit kuat bisa kita temukan pada larutan garam NaCl yang terurai dengan sempurna. Ketika NaCl(aq) dilarutkan dengan H2O maka akan menghasilkan Na+(aq)+ Cl-(aq). Dengan kondisi terurai sempurna, NaCl tidak lagi menyatu, semua ionnya sudah terpisah.
2. Elektrolit Lemah
Bagaimana dengan elektrolit lemah? Kamu bisa menemukan elektrolit lemah pada larutan cuka (CH3COOH). Pada larutan asam cuka hanya sebagian saja yang terurai karena didalamnya masih ada molekul reaktan.
3. Non Elektrolit
Larutan non elektronik tidak menghasilkan ion-ion seperti pada garam dan asam cuka. Apa saja yang termasuk larutan non elektrolit? Salah satunya adalah gula C6H12O6 (s). Ketika padatan gula dilarutkan H2O maka tidak menghasilkan ion dan tidak terurai.
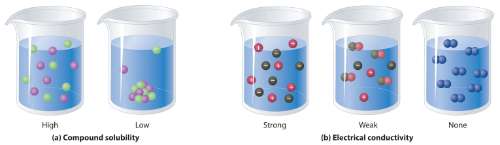
Perbedaan Larutan Elektrolit dan larutan Non Elektrolit
Seperti yang telah dijelaskan sebelumnya, larutan elektrolit dan larutan non elektronik memiliki sejumlah perbedaan. Diantaranya adalah seperti berikut ini:
| Elektrolit | Non Elektrolit |
| Bisa menghantarkan listrik | Tidak bisa menghantarkan listrik karena tidak terionisasi |
| Derajat ionisasi antara 0 < ɑ < atau = 1 | Derajat ionisasi ɑ = 0 atau tidak bisa terionisasi |
| Jika diuji daya listrik akan menghasilkan banyak gelembung gas dan membuat lampu menyala | Tidak bisa digunakan untuk menyalakan lampu dan tidak akan menghasilkan gelembung gas pada elektroda |
| Merupakan penghantar listrik yang baik | Bukan penghantar listrik |
| Contoh: H3PO4, HCl, HF, H2SO4, HNO3 dan lain-lain | Contoh: larutan gula, larutan urea dan lain-lain |
Manfaat Larutan Elektrolit
Pada dasarnya pembahasan tentang derajat ionisasi pengertian rumus dan contohnya sangat berkaitan erat dengan larutan elektrolit yang menghasilkan ion-ion. Lantas apa saja manfaat dari larutan elektrolit dalam kehidupan sehari-hari?
Perlu diketahui bahwa larutan elektrolit memiliki manfaat yang cukup banyak. Salah satunya adalah sebagai sel elektrokimia pada baterai dan pengisian aki. Bahkan larutan elektrolit dijadikan sebagai parameter potensi pencemaran air di suatu wilayah.
Sementara di dalam tubuh manusia sendiri larutan elektrolit memiliki peran yang sangat penting. Karena berhubungan dengan metabolisme tubuh. Diantaranya adalah melancarkan impuls saraf, pembentuk hormon dan pengaktif enzim.
Pengertian Derajat Ionisasi
Setelah memahami tentang larutan elektrolit kuat, larutan elektrolit lemah dan larutan non elektrolit, termasuk manfaatnya, kita bisa lanjutkan materi pembahasan tentang derajat ionisasi, pengertian, rumus dan contonya secara lengkap. Yang akan dibahas kali ini adalah pengertian dari derajat ionisasi.
Arrhenius, seorang ilmuwan Swedia mengungkapkan bahwa zat elektrolit di dalam larutan akan terurai menjadi partikel bermuatan listrik yang disebut ion. Ionisasi pada asam akan menghasilkan ion hidrogen, sementara ionisasi pada basa akan menghasilkan hidroksida.
Ion tersebut terus bergerak dan mampu menghantarkan arus listrik. Jadi yang membedakan antara larutan elektrolit dengan non elektrolit adalah keberadaan ion di dalam larutan. Sementara banyaknya molekul asam atau basa yang terurai dinyatakan dengan derajat ionisasi. Apa itu derajat ionisasi?
Pada dasarnya derajat ionisasi adalah suatu bentuk perbandingan antara jumlah molekul zat yang sudah terionisasi dibandingkan jumlah molekul zat mula-mula pada kondisi awalnya. Adapun lambang dari derajat ionisasi ini adalah (ɑ) atau alpha.
Berdasarkan pengertian di atas maka kita bisa mendapatkan rumus derajat ionisasi seperti berikut:
Rumus ɑ (derajat ionisasi)
(ɑ) derajat ionisasi alpha merupakan hasil dari jumlah molekul pada zat yang terionisasi dibagi dengan jumlah molekul zat mula-mula. Atau dengan kata lain derajat ionisasi adalah hasil bagi dari jumlah total molekul elektrolit yang sudah terionisasi menjadi kumpulan ion-ion.
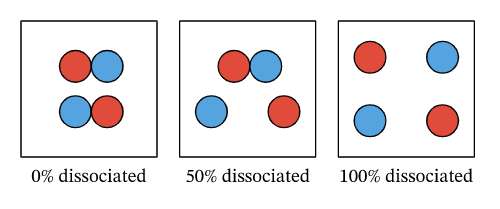
Derajat ionisasi elektrolit kuat dan lemah
Sementara banyaknya konsentrasi yang menjadi ion akan tergantung pada alpha (ɑ) atau derajat ionisasinya. Derajat ionisasi ini nantinya akan digunakan untuk menunjukkan adanya kekuatan asam atau basa. Adapun penjelasannya adalah seperti berikut:
| Jenis Larutan | Derajat Ionisasi |
| Elektrolit Kuat | Derajat ionisasi sempurna ɑ=1 atau 100% |
| Elektrolit Lemah | Derajat ionisasi sebagian 0<ɑ<1 atau ɑ=0,5 |
| Non Elektrolit | Tidak memiliki derajat ionisasi, ɑ=0 |
Derajat ionisasi digunakan untuk mengetahui bagaimana proporsi zat yang sudah terionisasi sehingga menghasilkan molekul yang memiliki muatan. Sementara reaksi ionisasi pada larutan asam maupun basa menunjukkan adanya reaksi keseimbangan disosiasi.
Hubungan Rumus Derajat Ionisasi dengan Kekuatan Asam dan Basa
Untuk lebih memahami tentang derajat ionisasi pengertian rumus dan contohnya, kita perlu memahami bagaimana hubungan rumus derajat ionisasi dengan kekuatan asam dan basa. Perlu diketahui bahwa kekuatan asam maupun basa pada larutan tergantung banyaknya ion yang terurai.
Berdasarkan jumlah ion yang terurai pada larutan, maka larutan asam dan basa bisa dibedakan menjadi larutan elektrolit kuat dan larutan elektrolit lemah seperti yang telah disinggung di awal.
Elektrolit sendiri merupakan mineral yang ada di dalam larutan dan memiliki muatan listrik. Sementara kemampuan suatu zat atau larutan dalam menghasilkan ion H+ akan menentukan kekuatan asam pada zat tersebut. semakin banyak ion H+ yang dihasilkan maka semakin kuat sifat asam pada zat.
Demikian pula sebaliknya, pada kekuatan basa kemampuan dalam menghasilkan ion OH- akan menentukan bagaimana kekuatan basa dari suatu zat. Semakin tinggi jumlah ion OH- yang dihasilkan maka hal itu menunjukkan bahwa semakin kuat sifat basa dari suatu larutan.
Sedangkan jumlah ion H+ maupun OH- akan dipengaruhi nilai derajat ionisasi atau alpha. Adapun beberapa contoh larutan elektrolit yang termasuk asam kuat antara lain adalah HCl, H2SO4, Hl, HBr, HNO3 dan lain-lain. Contoh basa kuat adalah KOH, NaOH, BaOH, Ca(OH)2 dan lain-lain.
Rumus Derajat Ionisasi Elektrolit
Dalam mempelajari derajat ionisasi, pengertian, rumus dan contohnya, salah satu yang penting untuk dipahami adalah rumus derajat ionisasi yang akan dijelaskan secara lengkap di bawah ini. Sebelumnya telah dijelaskan bahwa lambang derajat ionisasi adalah alpha (ɑ) adapun rumusnya adalah:
|
ɑ = jumlah molekul yang terionisasi : jumlah molekul mula-mula
|
|
Jumlah molekul terionisasi = ɑ x jumlah molekul mula-mula
|
|
Jumlah molekul mula-mula = jumlah molekul terionisasi : ɑ
|
|
Jumlah molekul zat = massa zat : Mr atau Ar zat
|
|
Jumlah molekul zat = M x V
|
|
Massa zat = jumlah molekul x Mr atau Ar zat
|
Keterangan:
ɑ : derajat ionisasi
Mr : massa molekul relatif
Ar : massa unsur relatif
M : molaritas zat
V : volume zat
Contoh Soal
Untuk lebih memahami materi derajat ionisasi pengertian rumus dan contohnya, kamu perlu mempelajari rumus derajat ionisasi yang telah diuraikan di atas. Berikut adalah contoh soal mencari derajat ionisasi yang bisa dijadikan latihan:
Contoh 1
Suatu senyawa R sebanyak 60 gram dilarutkan ke dalam air dan 30 gram senyawa tersebut mengalami ionisasi. Berapakah derajat ionisasi dari senyawa R?
Pembahasan:
Diketahui:
Jumlah molekul mula-mula = 60 gram
Jumlah molekul terionisasi = 30 gram
ɑ = jumlah mol terionisasi : jumlah mol mula-mula
= 30 gram : 60 gram
= ½ atau 0,5 gram
Jadi derajat ionisasi dari senyawa R adalah 0,5 gram
Contoh 2
Sebanyak 80 gram senyawa X dilarutkan ke dalam air dan 20 gram senyawa tersebut mengalami ionisasi. Berapakah derajat ionisasi dari senyawa R?
Pembahasan:
Diketahui:
Jumlah molekul mula-mula = 80 gram
Jumlah molekul terionisasi = 20 gram
ɑ = jumlah mol terionisasi : jumlah mol mula-mula
= 20 gram : 80 gram
= 1/4 atau 0,25 gram
Jadi derajat ionisasi dari senyawa X adalah 0,25 gram
Contoh 3
Suatu zat dilarutkan ke dalam 200 ml air dengan konsentrasi 0,2 M. Jika larutan tersebut terionisasi 2% maka berapakah massa zat yang telah terurai. Diketahui Mr zat = 50.
Pembahasan:
Diketahui:
M = 0,2 M
V = 200 ml = 0,2 L
ɑ = 2% = 0,02
Mr = 50
- Jumlah molekul mula-mula = M x V
Jumlah molekul mula-mula = 0,2 mol/L x 0,2 L
Jumlah molekul mula-mula = 0,04 mol
Jumlah molekul zat terurai = (ɑ x jumlah mol mula-mula)
Jumlah mol zat terurai = 0,02 x 0,04
Jumlah mol zat terurai = 0,0008 atau 8 x 10-4
- Massa zat terurai = jumlah molekul zat terurai x Mr atau Ar
Massa zat terurai = 0,0008 x 50
Massa zat terurai = 0,04 gram
Jadi massa zat terurai pada larutan tersebut sebesar 0,04 gram
Contoh 4
Suatu zat dilarutkan ke dalam 200 ml air dengan konsentrasi 0,4 M. Jika larutan tersebut terionisasi 3% maka berapakah massa zat yang telah terurai. Diketahui Mr zat = 60.
Pembahasan:
Diketahui:
M = 0,4 M
V = 200 ml = 0,2 L
ɑ = 2% = 0,03
Mr = 60
- Jumlah molekul mula-mula = M x V
Jumlah molekul mula-mula = 0,4 mol/L x 0,2 L
Jumlah molekul mula-mula = 0,08 mol
Jumlah molekul zat terurai = (ɑ x jumlah mol mula-mula)
Jumlah mol zat terurai = 0,03 x 0,08
Jumlah mol zat terurai = 0,0024
- Massa zat terurai = jumlah molekul zat terurai x Mr atau Ar
Massa zat terurai = 0,0024 x 60
Massa zat teruraai = 0,144 gram
Jadi massa zat terurai pada larutan tersebut sebesar 0,144 gram
Dapat disimpulkan bahwa derajat ionisasi merupakan hasil pembagian antara jumlah molekul yang terionisasi dengan molekul mula-mula. Bagaimana, sampai di sini apakah kamu sudah semakin paham dengan materi derajat ionisasi pengertian rumus dan contohnya?
Baca Juga :